Jedes Jahr erkranken weltweit Millionen Reisende an der sog. Reisediarrhö. Ca. 20-50% aller Reisenden aus Industrieländern in Entwicklungsländer bzw. in die Tropen sind davon betroffen (2) und 5-10% entwickeln die typischen Symptome der Dysenterie, d.h. blutige Stühle und Fieber (3). Auch bei Rückkehrern von Reisen ist Durchfall ein häufiges Symptom (1). Dabei sollte in akut, persistierend und chronisch unterschieden werden (4):
- Akute Diarrhö: drei oder mehr wässrige Stühle pro Tag kürzer als zwei Wochen.
- Persistierende Diarrhö: drei oder mehr wässrige Stühle pro Tag länger als zwei Wochen.
- Chronische Diarrhö: drei oder mehr wässrige Stühle pro Tag länger als vier Wochen.
Die akute Reisediarrhö wird meist durch enteropathogene Escherichia coli (z.B. Enterotoxigene E. coli = ETEC oder Enteroaggregative E. coli = EAEC), aber auch durch Campylobacter, Salmonellen und Shigellen verursacht. Bei der chronischen infektiösen Reisediarrhö dominiert Giardia lamblia (5). In den letzten Jahren wurden von den pharmazeutischen Unternehmern viele Mittel angepriesen. Sie haben aber alle keinen entscheidenden Fortschritt gebracht. Für die Menschen in den bereisten Entwicklungsländern sind sie sogar eine Gefahr durch Entwicklung von Erreger-Resistenz.
Akute Reisediarrhö: Jährlich reisen über eine Milliarde Menschen von entwickelten Ländern (Nordamerika und Europa) in Entwicklungsländer (Afrika, Asien, Südamerika; 6). Ca. 40% der Fernreisenden bekommen zwischen dem 3. und 9. Reisetag Diarrhö. Im Gegensatz zur nicht-reisebedingten Diarrhö ist sie meist durch Bakterien verursacht. Sie kann mit oder ohne Erbrechen, Fieber und blutigen Durchfällen verlaufen. Nach Untersuchungen aus den Jahren 1997-2011 sind „akute bakterielle Diarrhö“, „unspezifische akute Diarrhö“, „chronische Diarrhö unklarer Ursache“, „Giardiasis“ und ein „postinfektiöses Reizdarm-Syndrom“ die häufigsten Diagnosen nach Reisen (insgesamt 13.059 Diagnosen bei 10.032 Patienten; 7).
Geographische Unterschiede: Während oder nach Aufenthalten in Afrika, Indien oder Südamerika erleiden 10-60% der Reisenden eine Diarrhö, während oder nach Aufenthalten in Russland, China oder im Mittleren Osten sind es 8-15% (4). Nicht nur das Risiko, sondern auch das Erregerspektrum ist geographisch unterschiedlich (vgl. Tab. 1 und 2).
Spektrum der Erreger bei akuter Reisediarrhö: Bei der selbstlimitierenden akuten Reisediarrhö ist in der Regel keine eingehende Diagnostik erforderlich. In Studien mit aufwendigen, teilweise auch molekularbiologischen Methoden wird bei bis zu 76% der Patienten mindestens ein Enteropathogen erfasst, mit den derzeit angewendeten Routineverfahren nur bei 17% (9). Das Spektrum der Erreger ist bei akuter infektiöser Reisediarrhö vielfältig. Enteropathogene Bakterien wie ETEC, EAEC und Campylobacter sowie Giardia lamblia zählen zu den häufigsten Erregern in allen geographischen Regionen. Hingegen ist der Import von Cholera eine Rarität. In einer Studie mit Reisenden aus Australien wurden Shigellen als häufigste Erreger bei akuter Reisediarrhö gefunden (8).
Malaria: Bei Patienten, die mit Fieber und Diarrhö aus den Tropen zurückkehren, sollte unbedingt auch eine Malaria-Untersuchung durchgeführt werden, denn 13% der Patienten, bei denen eine Malaria diagnostiziert wurde, gaben Diarrhö als führendes Symptom an (10). Bei schottischen Reiserückkehren aus Borneo und Malaysia wurde Plasmodium knowlesi als seltener Erreger gefunden (11).
Ebola: Die Infektion mit dem Ebola-Virus betrifft zwar nicht in erster Linie Touristen, aber durchaus in Afrika tätiges medizinisches Personal, wie sich im Rahmen des sehr großen Ausbruchs in Westafrika gezeigt hat. Zu den häufigen Symptomen dieser gefährlichen hämorrhagischen Viruserkrankung gehörten auch Diarrhö und Erbrechen (12).
Persistierende und chronische Reisediarrhö: Besonderer diagnostischer Aufwand ist nötig, wenn die Reisediarrhö länger als zwei Wochen (persistierende Diarrhö) oder länger als vier Wochen anhält (chronische Diarrhö) und bis dahin keine Ursache gefunden wurde. Dann ist eine weitergehende Diagnostik indiziert, die auch endoskopische Verfahren einschließt. Das Erregerspektrum ist anders als bei akuter Diarrhö; meist werden Parasiten als Erreger gefunden (vgl. Tab. 3).
Giardia lamblia: Dieser Parasit verursacht am häufigsten die chronische Diarrhö nach Fernreisen (5). Zur Diagnostik sind Stuhluntersuchungen ausreichend, am besten mit dem hochsensitiven Fluoreszenztest. Eine obere Endoskopie bringt keinen zusätzlichen diagnostischen Gewinn (5).
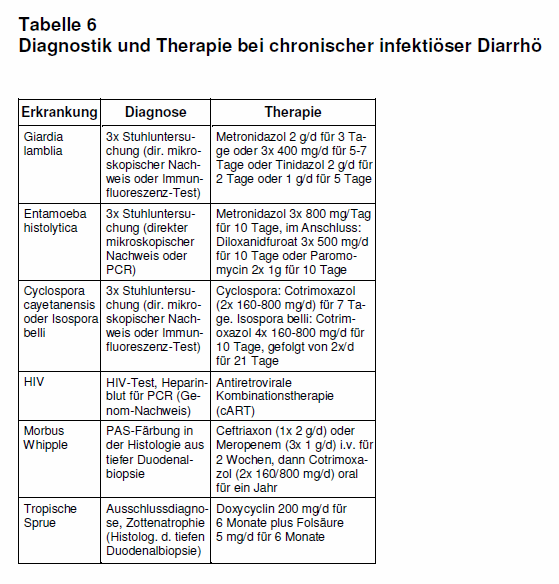
Tropische Sprue: Bei Patienten mit chronischer Diarrhö nach Tropenaufenthalt, bei denen kein Erreger im Stuhl gefunden wurde und die keine HIV-Infektion erworben haben, ist eine Gastro-Duodenoskopie indiziert. Das hierbei gewonnene Biopsiematerial sollte auch auf eine Zottenatrophie hin untersucht werden, denn bei Zottenatrophie und fehlendem Erregernachweis im Stuhl ist an eine Tropische Sprue zu denken. Diese Krankheit, die auf Besiedelung des Dünndarms mit coliformen Bakterien zurückgeführt wird, wird zwar selten von Touristen importiert, kann aber sehr schwer verlaufen. Ist die Diagnose gestellt, führt eine adäquate Behandlung fast immer zum Erfolg (vgl. Tab. 6).
HIV-Infektion: Bei Reisen können auch sexuell übertragbare Erkrankungen erworben werden. Insbesondere eine akute HIV-Infektion führt nicht selten zu Diarrhö. Bei entsprechendem Risiko sollte daher auch eine HIV-PCR durchgeführt werden, denn im frühen Stadium der Infektion können die Antikörper-Tests (ELISA, Western-Blot) noch negativ sein.
Erregerspektrum bei Immunsupprimierten: Bei Patienten mit fortgeschrittener HIV-Infektion und CD4+-T-Zellen < 100/µl oder anderen Immundefekten sowie Patienten mit immunsuppressiver Therapie erweitert sich das Erregerspektrum bei chronischer Diarrhö (vgl. Tab. 3).
Schistosomiasis (Bilharziose): Eine während der Reise erworbene Schistosomiasis kann sich als akute oder als chronische Durchfallerkrankung manifestieren. Die sorgfältige Anamnese mit der Frage nach Süßwasserkontakt (z.B. Baden in Flüssen) ist wichtig (13). Falls die Eier der Schistosomen im Stuhl nicht nachgewiesen werden konnten – sie werden nur intermittierend ausgeschieden – ist bei manchen Patienten eine Koloskopie hilfreich. Bei sorgfältiger Untersuchung sind die nodulären Läsionen in der Schleimhaut gut zu erkennen und in Biopsien aus diesen Arealen auch die Eier zu finden.
Clostridium difficile: Durch die weltweit unkritische Verordnung und Verwendung von Antibiotika ist auch bei Reisenden die Clostridium-difficile-assoziierte Diarrhö häufiger geworden. Typischerweise sind es junge Reisende aus Industrieländern, die betroffen sind (14).
Morbus Whipple: Bei französischen Reisenden nach Senegal wurde mittels PCR der Erreger im Stuhl nachgewiesen, wobei diese Untersuchung vor der Reise noch negativ war. Bei einigen dieser Reisenden war sonst kein weiteres Enteropathogen im Stuhl nachweisbar, so dass Tropheryma whipplei möglicherweise auch zu den Erregern der Reisediarrhö gezählt werden muss (15; vgl. Tab. 3).
Postinfektiöses Reizdarm-Syndrom nach Reisediarrhö: Eine Assoziation zwischen Reizdarm-Syndrom und Reisediarrhö ist nicht klar. Die Ergebnisse aus Studien reichen von keiner Assoziation bis hin zu einem fünffach erhöhten Risiko (16, 17). Eine Studie ermittelte bei US-Amerikanern mit Reizdarm-Syndrom bei ca. 10% eine Fernreise in den letzten sechs Monaten (18). Derzeit ist keine sichere Aussage zu dieser Frage möglich.
Prophylaxe der Reisediarrhö: Hierzu gibt es prinzipiell vier Ansätze: Nahrungsmittelhygiene, Antibiotika, nicht-antibiotische Optionen und Impfungen. Am besten ist eine penible Nahrungsmittelhygiene (cook it, boil it, peel it, or forget it), die aber meist nicht eingehalten wird (19). Besonders bei den Getränken sollte darauf geachtet werden, dass nur gekochtes oder in Flaschen abgefülltes oder mit Kohlensäure versetztes Wasser getrunken wird. Das Wasser sollte mindestens eine Minute lang gekocht werden (in Höhen > 2000 m mindestens drei Minuten). Da auch in Flaschen abgefülltes Wasser die Ursache für Ausbrüche von Durchfallerkrankungen in Portugal und Mexiko war (20, 21), sollte zumindest auf eine intakte Versiegelung der Flaschen geachtet werden.
Eine Antibiotikaprophylaxe ist nur für besondere Risikopatienten zu empfehlen. Dies sind Patienten mit HIV-Infektion und niedrigen CD4+ T-Zellzahlen (< 100/µl), aktiven chronisch entzündlichen Darmerkrankungen, insulinpflichtigem Diabetes mellitus, schwerer Herzerkrankung oder Patienten mit unvermeidbarer Therapie mit einem Protonenpumpen-Hemmer. Protonenpumpen-Hemmer erhöhen den ph-Wert im Magen und reduzieren dadurch den Schutz vor Infektionen mit enteropathogenen Bakterien. Grundsätzlich sollten solche Risikopatienten von Reisen in die Tropen absehen. Bei unvermeidlichen Reisen in Länder mit hohem Risiko für eine Reisediarrhö (bei Aufenthalten < 2 Wochen), kann eine Antibiotikaprophylaxe mit Ciprofloxacin oder Rifaximin (ein gering resorbierbares Antibiotikum) erwogen werden (vgl. Tab. 4; 22). Über potenzielle Nebenwirkungen von Antibiotika sind die Patienten aufzuklären. Andere, früher häufig eingesetzte Antibiotika, wie z.B. Doxycyclin oder Sulfonamide, verlieren bei dieser Indikation wegen zunehmender Resistenz der Erreger an Bedeutung (23). Rifaximin ist prophylaktisch insgesamt nur schwach wirksam (24, 25). Bei Durchsicht der Literatur fällt auf, dass die vom Hersteller finanzierten Studien (federführender Autor DuPont) über gute Ergebnisse berichten (26, 27), während andere keinen signifikanten Unterschied zu Plazebo fanden (28, 29). Besonders in Südostasien ist Rifaximin prophylaktisch schlecht wirksam (24), und multiresistente E. coli können selektiert werden (30). Die Indikation für eine antibiotische Prophylaxe der Reisediarrhö sollte restriktiv gestellt werden – dies nicht nur wegen des unsicheren Nutzens und möglicher Nebenwirkungen, sondern auch, weil sich bakterielle Resistenzen in den bereisten tropischen Ländern ausbreiten können (31).
Von den nicht-antibiotischen Optionen wurde bisher am häufigsten Wismutsubsalicylat als Lösung oder als Kautablette eingesetzt. In Deutschland hat die Substanz an Bedeutung verloren und ist als Präparat nicht mehr im Handel, jedoch noch in Nordamerika. Die Wirkung ist mild antimikrobiell, antisekretorisch und antiinflammatorisch (32). Wismutsubsalicylat reduzierte die „attack rate” der Reisediarrhö von 40% auf 14% verglichen mit Plazebo (33). Wismutverbindungen färben die Zunge und den Stuhl schwarz. Tinnitus ist als Nebenwirkung beschrieben. Bisherige Studien mit Probiotika (Saccharomyces boulardii, verschiedene Stämme von Lactobacillus) zur Reduktion der Inzidenz von Reisediarrhö ergaben sehr unterschiedliche Ergebnisse; die Wirksamkeit reicht von 0-47% (34). Der Nutzen in dieser Indikation ist nicht gesichert.
Impfstoffe: Es gibt keine marktreifen Produkte. Eine klinische Studie mit einem auf E. coli-Toxin basierenden Impfstoff hat keine protektive Wirksamkeit gezeigt (35). Entsprechend ernüchternd ist eine Cochrane-Analyse (36).
Therapie der Reisediarrhö: Wie bei anderen Formen der akuten infektiösen Diarrhö ist auch bei dieser die Substitution von Flüssigkeit und Elektrolyten die wichtigste therapeutische Maßnahme. Bei milder Diarrhö können die Flüssigkeits- und Mineralverluste durch Trinken kohlensäurehaltiger Getränke, Salzstangen und Suppen oder auch mit speziellen Mischungen von Mineralien meist oral ausgeglichen werden. Bei großem Flüssigkeitsverlust sollte die Substitution intravenös erfolgen. Spezielle Diäten haben keinen Stellenwert bei der infektiösen Diarrhö (37). Motilitätshemmer (z.B. Loperamid) sollten nicht länger als 48 h eingenommen werden und bei Fieber und/oder blutigen Stühlen (Dysenterie) überhaupt nicht. Kohlepräparate werden zwar immer noch als Adsorbentien eingesetzt. Die Wirksamkeit ist jedoch nicht belegt.
Eine antibiotische Therapie kann die Dauer der Diarrhö und der abdominellen Krämpfe manchmal um einige Stunden verkürzen, wenn der Erreger auf das Antibiotikum sensibel ist (38). Generell sollte eine akute Reisediarrhö aber nicht antibiotisch behandelt werden. Früher wurden Sulfonamide eingesetzt, heute sind es meist Fluorochinolone (z.B. Ciprofloxacin). Als neueres Antibiotikum wird Rifaximin stark beworben (22). In Indien und Asien, wo die Erreger der Reisediarrhö gegen Fluorochinolone bereits häufig resistent sind, werden jetzt zunehmend auch Resistenzen gegen Rifaximin gefunden. In Peru ist Rifaximin kaum noch wirksam (39).
Einige Vorschläge für Reisende in entlegene tropische Regionen, die nicht immer sofort einen Arzt konsultieren können, sind in Tab. 5 zusammengefasst. Eine Selbsttherapie bei Reisediarrhö sollte jedoch nur kurze Zeit erfolgen.
Im Gegensatz zur akuten Diarrhö ist bei der chronischen infektiösen Diarrhö fast immer eine spezielle Therapie notwendig, die jedoch erst nach entsprechender Diagnostik eingeleitet werden kann (s. Tab. 6).
Fazit für die Praxis: Die wichtigste therapeutische Maßnahme bei infektiöser Diarrhö – unabhängig von der Ursache – ist die Flüssigkeits- und Elektrolytsubstitution. Bei Reiserückkehrern mit chronischer Diarrhö, bei denen Stuhluntersuchungen die Ursache nicht klären, sollte eine umfangreiche Diagnostik unter Einschluss endoskopischer Verfahren erfolgen. Die Ursachen der chronischen Diarrhö sind bei Immungeschwächten vielfältig, bei Immunkompetenten ist Giardia lamblia der häufigste Erreger. Bei Reisenden, die mit Fieber und Diarrhö aus den Tropen zurückkehren, sollte auch eine Malaria-Untersuchung stattfinden, denn Diarrhö kann führendes Symptom bei akuter Malaria sein.
Übermäßiger und nicht sachgerechter Einsatz von Antibiotika hat die Resistenz der Diarrhö-Erreger gefördert. Bei vielen Darminfektionen helfen Antibiotika nicht; sie können den Verlauf sogar verschlimmern (z.B. EHEC) oder eine neue Krankheit induzieren, z.B. Antibiotika-assoziierte Diarrhö und Pseudomembranöse Kolitis. Die beste Prophylaxe für eine Reisediarrhö ist nach wie vor die penible Nahrungsmittelhygiene (s.o.). Die Entwicklung von Impfstoffen gegen die Reisediarrhö ist wünschenswert, aber derzeit noch nicht erfolgreich. Für die Reiseapotheke bei Fernreisen in unterentwickelte Länder können folgende Arzneimittel hilfreich sein: Elotrans (zur Elektrolyt- und Kohlehydratsubstitution), Loperamid, Wismutsubsalicylat und von den Antibiotika (je nach Region) ein Fluorochinolon (z.B. Ciprofloxacin, Ofloxacin), Azithromycin, Rifaximin.
Literatur
- Harms, G., et al.: Dtsch. Med.Wochenschr. 2002, 127,1748. Link zur Quelle
- Gorbach, S.L., et al.:JAMA 1985, 253, 2700. Link zur Quelle
- Cobelens, F.G., et al. Trop. Med. Int. Health 1988, 3, 896.Link zur Quelle
- Zaidi, D., und Wine, E.: Curr. Opin. Gastroenterol. 2015, 31, 7. Link zur Quelle
- Wahnschaffe, U., et al.: Scand. J. Gastroenterol. 2007, 42, 391. Link zur Quelle
- de la Cabada Bauche, J., und DuPont,H.L.: Gastroenterol. Hepatol.(NY) 2011, 7, 88. Link zur Quelle
- Harvey, K., et al.:MMWR Surveill. Summ. 2013, 62, 1.Link zur Quelle
- Gunaratnam, P., etal.: North South Wales Public Health Bull. 2014, 24, 171. Link zur Quelle
- Antikainen, J., et al.:Clin. Gastroenterol. Hepatol.2013, 11, 1300. Link zur Quelle
- Jelinek, T., et al.:J. Travel Med. 1994, 1, 199. Link zur Quelle
- Cordina, C.J., et al.:J. Travel Med. 2014, 21, 357. Link zur Quelle
- AMB 2014, 48,67. Link zur Quelle
- Karcher, H., et al.: Int.J. Colorectal Dis. 2008, 23, 1021. Link zur Quelle
- Neuberger, A., et al.: J.Travel Med. 2013, 20, 37. Link zur Quelle
- Gautret, P., et al.:Travel Med. Infect. Dis. 2014, 12, 264. Link zur Quelle
- Ilnyckyj, A., et al.: Am.J. Gastroenterol. 2003, 98, 596. Link zur Quelle
- Stermer, E., et al.: Clin.Infect. Dis. 2006, 43, 898. Link zur Quelle
- DuPont, H.L., et al.:Am. J. Trop. Med. Hyg. 2010, 82, 301. Link zur Quelle
- Kozicki, M., et al. Int.J. Epidemiol 1985, 14, 169. Link zur Quelle
- Blake, P.A., et al.: Am.J. Epidemiol. 1977, 105, 344. Link zur Quelle
- Gonzalez-Cortes, A., etal. Am J. Public Health 1982,72, 844. Link zur Quelle
- AMB 2005, 39, 75 Link zur Quelle. AMB 2006, 40, 73. Link zur Quelle
- Hoge, C.W., et al.: ClinInfect Dis. 1998, 26, 341. Link zur Quelle
- Zanger, P., et al. LancetInfect. Dis. 2013, 13, 946. Link zur Quelle
- Alajbegovic, A., et al.:Syst. Rev. 2012, 1, 39. Link zur Quelle
- DuPont, H.L., et al.:Ann. Intern. Med. 2005, 142, 805.Link zur Quelle Erratum: Ann. Intern. Med. 2005, 143, 239.
- Martinez-Sandoval, F.,et al.: J. Travel Med. 2010,17, 111. Link zur Quelle
- Flores, J., et al.: J.Travel Med. 2011, 18, 333. Link zur Quelle
- Amstrong, A., et al.J. Travel Med. 2011, 17, 392. Link zur Quelle
- Hopkins, K.L., et al.:Int. J. Antimicrob. Agents 2014, 43, 431. Link zur Quelle
- Ruiz, J., und Pons, M.J.:Lancet Infect. Dis. 2013, 13,911. Link zur Quelle
- Gorbach, S.L.:Gastroenterology 1990, 99, 863. Link zur Quelle
- Steffen, R., et al.:Antimicrob. Agents Chemother.1986, 29, 625. Link zur Quelle
- Scarpignato, C., undRampal, P.: Chemotherapy 1995, 41 Suppl. 1,48. Link zur Quelle
- Behrens, R.H., et al.:Lancet Infect. Dis. 2014, 14, 197. Link zur Quelle
- Ahmed, T., et al.:Cochrane Database Syst. Rev. 2013, 7, CD009029. Link zur Quelle
- Huang, D.B., et al.:Clin. Infect. Dis. 2004, 39, 468. Link zur Quelle
- De Bruyn, G., et al.:Cochrane Database Syst. Rev. 2000, 3, CD002242. Link zur Quelle
- Gomes, C., et al.: Trans.R. Soc. Trop. Med. Hyg. 2013, 107, 545. Link zur Quelle