Zusammenfassung: Hinsichtlich Verhinderung kardiovaskulärer Ereignisse war in der SEARCH-Studie die höhere Dosis von 80 mg/d Simvastatin der Standarddosis von 20 mg/d trotz stärkerer Senkung des LDL-Cholesterins (LDL-C) nicht signifikant überlegen. Dagegen kommt die Metaanalyse der Cholesterol Treatment Trialists bei Auswertung von 26 Studien mit insgesamt 170.000 Patienten zu dem Ergebnis, dass Standarddosierungen von Statinen das relative Risiko kardiovaskulärer Ereignisse, verglichen mit Plazebo – wie bekannt – signifikant verringern und höhere Dosierungen nicht nur das LDL-C, sondern auch kardiovaskuläre Risiken signifikant zusätzlich senken. Da vor allem Patienten mit hohem Gesamtrisiko von einer Statintherapie profitieren, liegt es nahe, bei diesen Patienten die Statindosis anzupassen (dem LDL-C und dem Risiko) und bei hoher Dosis sorgfältig auf UAW zu achten. Bei Patienten mit gegebener Indikation für Statine, aber mit nicht sehr hohem Risiko erscheint die Verordnung einer Standarddosis vertretbar. Dieses Vorgehen ist logisch, aber bisher nicht durch vergleichende Studien abgesichert.
Über die Indikation zur Therapie mit Statinen und die angemessene Dosierung gibt es nach wie vor Diskussionen. Wir hatten 2005, gestützt auf die damalige Nutzenbewertung der Statine durch das IQWiG, folgende Meinung vertreten: „(es)… lässt sich nicht ableiten, dass das Ausmaß der LDL-C-Senkung geeignet ist, den Nutzen hinsichtlich patientenrelevanter Endpunkte generell zu belegen oder zu quantifizieren” (1). Das würde bedeuten, es lohnt sich nicht, eine initial erreichte Senkung des LDL-C gegebenenfalls durch eine höhere Dosis des Statins oder einen anderen Lipidsenker zu verstärken. Neuere große, allerdings nicht endgültig beweisende Untersuchungen lassen vermuten, dass es Patienten gibt, bei denen eine intensivere Senkung des LDL-C klinisch vorteilhaft sein kann (2-4). Aber nach wie vor wird die optimale Dosierung kontrovers diskutiert. Daher sind zwei im November vorigen Jahres im Lancet veröffentlichte Studien und ein Editorial im gleichen Heft von großem Interesse (5-7).
Die SEARCH-Studie (5) ist eine doppelt verblindete, randomisierte, kontrollierte Untersuchung, in der 12.064 Patienten mit Myokardinfarktanamnese entweder mit 20 mg/d oder mit 80 mg/d Simvastatin behandelt und dann durchschnittlich 6,7 Jahre lang beobachtet wurden. Patienten, die in der Run-in-Phase 20 mg/d Simvastatin nicht vertrugen oder in der Einnahme nicht zuverlässig waren, schieden vor der Randomisierung aus. In der Hochdosis-Gruppe sank das LDL-C deutlich stärker (um 0,35 mmol/l = 13,5 mg/dl im Gruppenvergleich), die kardiovaskulären Ereignisse nahmen jedoch nicht signifikant im Vergleich mit der Niedrigdosis-Gruppe ab. Für „Major coronary events” (primärer Endpunkt, bestehend aus nicht-tödlichem Herzinfarkt, koronarer Revaskularisation und kardial bedingtem Tod) fand sich ein nicht-signifikant niedrigeres relatives Risiko (RR) von 0,96 (95%-Konfidenzintervall = CI: 0,89-1,04; p = 0,37) in der Hochdosis-Gruppe. Hinsichtlich tödlicher und nicht-tödlicher Schlaganfälle betrug das RR 0,91 (95%-CI: 0,77-1,08; p = 0,30). Für alle kardiovaskulären Ereignisse zusammen lag das RR bei 0,94 (95%-CI: 0,88-1,01; p = 0,10). Auch die Letalität im Beobachtungszeitraum war in beiden Gruppen nahezu identisch (16,0% in der Hochdosis-Gruppe, 16,1% in der Niedrigdosis-Gruppe) und hinsichtlich der Todesursachen fand sich ebenfalls kein signifikanter Unterschied.
Deutliche Unterschiede zeigten sich allerdings bei den unerwünschten Arzneimittelwirkungen (UAW). Zeichen einer Hepatopathie (Anstieg der GPT auf mindestens den zweifachen Normalwert) fanden sich bei 4,3% der Patienten in der Hochdosis-, aber nur bei 2,9% in der Niedrigdosis-Gruppe. Schwerere Lebererkrankungen traten allerdings in keiner Gruppe auf. Am deutlichsten war der Unterschied hinsichtlich der durch das Statin induzierten Myopathie. Hier lag das Risiko der Niedrigdosis-Gruppe mit 0,03% hochsignifikant unter dem der Hochdosis-Gruppe (1,4%). Die SEARCH-Studie (5) scheint also zu bestätigen, dass die mit niedriger Statindosis und mäßiger Senkung des LDL-C erreichte günstige Wirkung auf kardiovaskuläre Endpunkte durch eine höhere Dosierung und stärkere LDL-C-Senkung nicht wesentlich verbessert werden kann.
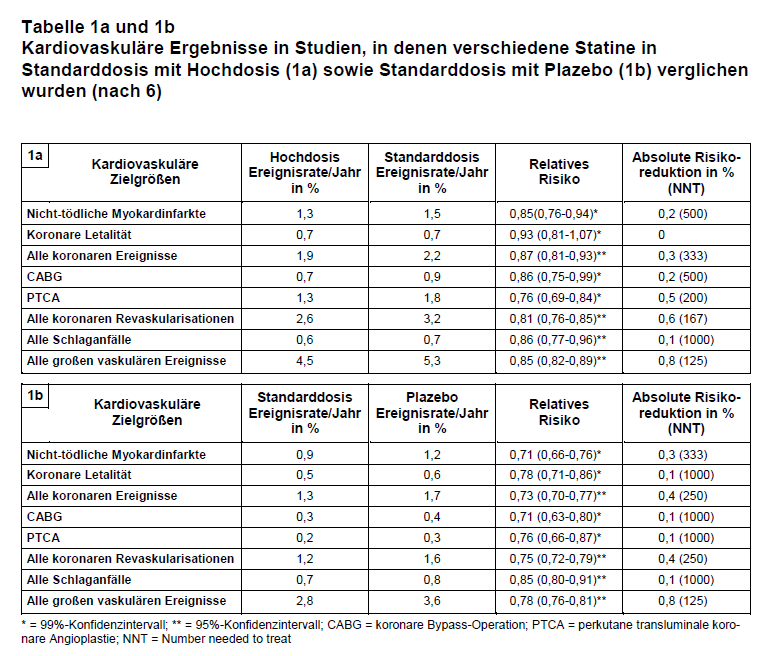
Die Mega-Metaanalyse der Cholesterol Treatment Trialists (CTT) kommt zu einem etwas anderen Ergebnis (6). Sie analysierte die Behandlungsergebnisse von 170.000 Patienten in allen bisher vorliegenden Studien. 21 waren plazebokontrolliert und fünf verglichen Standarddosis mit Hochdosis. Die Arbeitsgruppe benutzt eine spezielle Methodik für Metaanalysen, bei der die individuellen Patientendaten benutzt werden. So sind auch Ergebnisse in Untergruppen auswertbar. Mit dieser Methode wurde bereits 2005 die erste Metaanalyse erstellt (7). Nun wurde eine Aktualisierung veröffentlicht unter Berücksichtigung neuerer Untersuchungen (z.B. SEARCH, s.o,). Aufgenommen wurden Studien (primäre und sekundäre Prävention) mit mindestens 1000 Probanden und zweijähriger Behandlungsdauer. Letztlich waren dies fünf Studien, die Statine hoch dosiert mit normal dosiert verglichen (39.612 Probanden, mediane Beobachtungsdauer 5,1 Jahre) und 21 Studien, die Statine vs. Plazebo untersuchten (129.526 Probanden, mediane Beobachtungsdauer 4,8 Jahre).
Betrachtet man alle kardiovaskulären Ereignisse (definiert als koronare Ereignisse, koronare Revaskularisation oder Schlaganfall) fand sich ein RR von 0,85 (95%-CI: 0,82-0,89) zu Gunsten der Hochdosis. Auch das RR Statin vs. Plazebo war mit 0,78 (95%-CI: 0,76-0,81) zu Gunsten des Verums. In beiden Vergleichen resultiert eine Number needed to treat (NNT) von 125 für den kombinierten Endpunkt. Die Details sind in Tab. 1a und 1b dargestellt, so z.B. auch, dass die koronare Letalität unter der hohen Statindosis im Vergleich zur Standarddosis nicht signifikant geringer war. Auch hinsichtlich der Gesamtletalität zeigte sich kein Vorteil durch die Hochdosis-Behandlung.
Der wesentliche Vorteil von Metaanalysen mit individuellen Patientendaten ist es, dass verlässliche Subgruppenanalysen durchgeführt werden können, denn in allen Gruppen stehen ausreichend viele Patienten zur Verfügung. Für die Zielgröße „alle großen vaskulären Ereignisse” fand sich nahezu konstant eine Reduktion des RR von ca. 20% je 1 mmol/l (= 38,7 mg/dl) Senkung des LDL-C bei vielen Subgruppen (Geschlecht, Alter, Body Mass Index, koronare Vorerkrankung, arterielle Hypertonie, Diabetes, Raucher, LDL-C-Konzentration). Auch für Subgruppen mit unterschiedlichem Ausgangswert des LDL-C zeigte sich ein gleicher Nutzen. Als unerwünschte Wirkung wird ausschließlich über Myopathien berichtet, die bis zur Rhabdomyolyse fortschritten. Es zeigte sich unter der Hochdosis eine statistisch signifikante Erhöhung um vier Fälle pro 10.000 (95%-CI: 0,08-7,92) gegenüber der Standarddosis. Für diese Erhöhung seien vor allem zwei Studien verantwortlich, SEARCH (5) und A to Z trial (9): In beiden wurde Simvastatin 80 mg/d gegen Simvastatin 20 mg/d verglichen. Im Vergleich von Statin mit Plazebo fand sich keine statistisch signifikante Häufung solcher UAW.
Diskussion: In der SEARCH-Studie wurden mit 80 mg/d Simvastatin keine signifikant günstigeren Effekte auf den primären Endpunkt „Major coronary events” gesehen im Vergleich zu der Gruppe, die mit 20 mg/d behandelt wurde, aber Myopathien waren bei Hochdosis häufiger. Die CTT-Metaanalyse zeigt bei zusammenfassender Auswertung der vorhandenen Daten eine signifikante Überlegenheit der höheren Statindosis bezüglich LDL-C-Senkung und der vaskulären Endpunkte, nicht aber der kardialen oder der Gesamtletalität. Die absoluten Risikodifferenzen liegen zwischen 0,8% und 0,2%, d.h. es müssen 125 bis 500 Patienten behandelt werden, um einem Patienten einen Endpunkt zu ersparen (NNT). Ähnliche Risikoreduktionen werden übrigens auch erreicht durch die normal dosierte Statintherapie im Vergleich zu Plazebo. Die CTT-Metaanalyse wird auch kritisch kommentiert: Die eingeschlossenen Studien seien so heterogen, dass sich eine Metaanalyse verbiete. Außerdem seien einige der Studien fehlerhaft konzipiert, andere mit einer nicht transparenten Methodik in die Metaanalyse integriert worden.
In den in die Metaanalyse eingeschlossenen Studien wurden alle Patienten ohne Berücksichtigung ihres Risikoprofils und der aktuellen LDL-C-Werte behandelt. Hochrisikopatienten haben bei gleicher relativer Risikoreduktion eine größere absolute Risikoreduktion, eine höhere Dosis ist daher möglicherweise vorteilhaft. Die seit langem schwelende Frage, ob die Dosierung an die sich ergebenden LDL-C-Konzentrationen angepasst werden („treat to target”) oder ob eine einmal festgesetzte Dosis unverändert gegeben werden soll („fire and forget”) kann trotz des gewaltigen Zahlenmaterials immer noch nicht beweisend beantwortet werden. Dazu wäre ein direkter Vergleich der Methoden erforderlich. Aber eine intensivere Statintherapie bewirkt wahrscheinlich eine – wenn auch geringe – zusätzliche Risikoreduktion. Es bleibt dabei ungelöst, welche und wie viele Patienten von einer an Risiko und LDL-C-Konzentration angepassten Dosierung tatsächlich profitieren, denn das wurde nicht untersucht. Es ist ein Mangel der CCT-Studie, dass keine Untergruppen mit unterschiedlichen Ausgangsrisiken und Dosierungsschemata gebildet worden sind. „Die Intensität der Therapie muss sich nach dem Gesamtrisiko richten. Die relative Risikoreduktion ändert sich nicht wesentlich mit dem Gesamtrisiko. Der klinische Nutzen hängt mehr von der absoluten Risikoreduktion (bzw. NNT) ab als von der relativen Risikoreduktion. Patienten mit einem deutlich erhöhten kardiovaskulären Gesamtrisiko sollten eine lipidsenkende Therapie erhalten.” So einfach und doch differenziert beantwortet der Autor des Editorials im gleichen Heft des Lancet die Frage (8). Dieser Meinung schließen wir uns an. Ein erhöhtes LDL-C allein ist nur selten ein Grund zur Behandlung. Auf das Gesamtrisiko kommt es an.
Literatur
- AMB 2005, 39,70b Link zur Quelle und Nutzenbewertung der Statine: www.iqwig.de Link zur Quelle
- Cannon, C.P., et al. (PROVE IT-TIMI 22 = PRavastatinOr atorVastatin Evaluation and Infection Therapy- Thrombolysis In Myocardial Infarction 22):N. Engl. J. Med. 2004, 350, 1495. Link zur Quelle
- LaRosa, J.C., et al. (TNT = Treating to NewTargets): N. Engl. J. Med. 2005, 352, 1425. Link zur Quelle
- Pedersen, T.R., et al. (IDEAL = Incremental Decreasein End points through Aggressive Lipid lowering): JAMA2005, 294, 2437 Link zur Quelle . Erratum: JAMA 2005, 294,3092.
- SEARCH Collaborative Group (= Studyof the Effectiveness of Additional Reductions in Cholesteroland Homocysteine): Lancet 2010, 376, 1658. Link zur Quelle
- Baigent, C., et al. (CTT = CholesterolTreatment Trialists’ collaboration): Lancet 2010, 376,1670. Link zur Quelle
- Baigent, C., et al. (CTT = CholesterolTreatment Trialists‘ collaboration): Lancet 2005, 366,1267 16214597. Link zur Quelle
- Cheung, B.M., undLam, K.S.: Lancet 2010, 376, 1622. Link zur Quelle
- de Lemos, J.A., et al. (A to Z trial = Aggrastatto Zocor): JAMA 2004, 292, 1307. Link zur Quelle