Im Oktober ist der Arzneiverordnungs-Report 2002 erschienen (1). Er gibt wie immer einen in den Medien viel beachteten Überblick über das Verordnungsverhalten der deutschen Ärzte im Vorjahr. 3,5 Millionen kassenärztliche Rezepte des Jahres 2001 wurden ausgewertet. Der Anteil der umstrittenen Arzneimittel an den Verordnungen ist gesunken. Das Einsparpotential hier beträgt aber noch 1,2 Milliarden EUR. Es werden auch mehr Generika verschrieben, aber immer noch zu wenig. Das Einsparvolumen hier ist 1,5 Milliarden EUR. Die Entwicklung geht also in die richtige Richtung, ist aber noch nicht abgeschlossen.
Besonders interessant und aufschlußreich ist die Analyse der Verordnungspraxis 2001 von Präparaten, die erst im Jahre 2000 auf den Markt gekommen sind. Man sollte erwarten, daß sich überwiegend die Arzneimittel durchsetzen, die einen echten therapeutischen Fortschritt darstellen. Wenn dies nicht so ist, müssen wir uns fragen: „Was führt dazu, daß nicht die effektivste Arzneimitteltherapie gewählt wird?“ und: „Warum wird zu wenig Wert gelegt auf den Quotienten Kosten pro Wirkung?“
In Tab. 1 sind die Arzneimittel aufgelistet, die im Jahre 2000 neu zugelassen und im Jahre 2001 mehr als 20000 mal verordnet worden sind. In der letzten Spalte findet sich eine Bewertung in vier verschiedene Kategorien, die der Arzneiverordnungs-Report seit Jahren praktiziert:
A = Innovative Struktur bzw. neuartiges Wirkprinzip mit therapeutischer Relevanz,
B = Verbesserung pharmakodynamischer oder pharmakokinetischer Eigenschaften bereits bekannter Wirkprinzipien,
C = Analogpräparate mit marginalen oder keinen Unterschieden zu bereits eingeführten Präparaten,
D = Nicht ausreichend gesichertes Wirkprinzip oder unklarer therapeutischer Stellenwert.
Diese Klassifizierung hat Tradition und hat sich bewährt. Ein anderer anschaulicher Versuch, bloße ”Neuerung” von ”therapeutischem Fortschritt” begrifflich abzugrenzen, stammt von der International Society of Drug Bulletins (ISDB), die im November 2001 eine „Erklärung über den therapeutischen Fortschritt beim Gebrauch von Medikamenten“ verabschiedet hat (2). Danach müssen vom therapeutischen Fortschritt abgegrenzt werden: Umsatzorientierte Neuerungen (me too!) und Neuerungen im Herstellungsprozeß (z.B. Gentechnologie). Der therapeutische Fortschritt ist demgegenüber (frei übersetzt) die Zunahme des Quotienten aus Wirkung und Anwendungs-Komfort (z.B. niedermolekulare Heparine) dividiert durch Nebenwirkungshäufigkeit und Preis.
Betrachtet man unter diesen Gesichtspunkten die in Tab. 1 aufgeführten Arzneimittel, stellt man fest, daß sich vor allem Analogpräparate, also am Umsatz orientierte Neuerungen, durchgesetzt haben (z.B. der Protonenpumpenhemmer Esomeprazol = Nexium). Einen tabellarischen Vergleich der Protonenpumpenhemmer haben wir im Mai 2001 gebracht (3) und dargestellt, daß ihre Wirkung in vergleichbaren Dosierungen identisch ist und somit der Preis über die Verordnung entscheiden kann. Omeprazol als Generikum ist das preisgünstigste Medikament, aber die umsatzorientierte Neuerung hat sich durchgesetzt.
Celecoxib (Celebrex) wurde 692300 mal verordnet und Rofecoxib (Vioxx) 1627300 mal! Das ist ein kometengleicher Aufstieg dieser Substanzen in der Beliebtheitsskala von Medikamenten, die zur Behandlung von Gelenkschmerzen eingesetzt werden. Dabei ist das Nebenwirkungsspektrum beider Präparate nicht ganz klar. Im Beobachtungszeitraum der Zulassungsstudien – er betrug nur sechs Monate – war die Zahl gastrointestinaler Blutungen zwar geringer als bei den zum Vergleich herangezogenen NSAID, im weiteren Verlauf der Nachbeobachtung, über den in den Studien nicht mehr berichtet wurde, verwischte sich allerdings diese Differenz (4). Bei den Patienten, die weiter Azetylsalizylsäure (ASS) zur Prophylaxe thromboembolischer Ereignisse einnehmen mußten, war die Blutungshäufigkeit kaum geringer. Bei den Patienten, die keine ASS einnahmen, gab es aber mehr Schlaganfälle und Herzinfarkte. Darüber hinaus muß unter der Behandlung die Neigung zu Hypertonie und Herzinsuffizienz bedacht werden (5, 6). Warum werden trotzdem die Coxibe weltweit mit einem Milliarden-Umsatz verordnet?
Auch Insulin glargin (Lantus; 7) und die Glitazone (Rosiglitazon = Avandia; Pioglitazon = Actos; 8) wurden im Jahre 2000 neu zugelassen und von Anfang an sehr häufig verordnet, obwohl sie teurer sind als die zugelassenen Vergleichspräparate und ein bedenkliches Spektrum unerwünschter Wirkungen (UAW) haben. Beim Insulin glargin sind es Netzhautblutungen, die vermehrt beobachtet wurden (9). Bei Retinopathie sollte es daher nur bei zwingender Indikation verwandt werden. Besonders verwundert aber die Verordnungshäufigkeit der Glitazone. Sie senken zwar den Blutzucker (Surrogat-Parameter), aber wie sind sie klinisch zu bewerten, wenn nicht bekannt ist, ob auch die Komplikationen des Diabetes seltener auftreten und die UAW (Herzinsuffizienz, Ödeme) so schwerwiegend sind, daß sich manche Fachleute fragen, wie die Substanzen überhaupt zugelassen werden konnten. Auch wir hatten nach einer eingehenden Sichtung der Literatur von einer Verordnung außerhalb kontrollierter Studien dringend abgeraten, nicht nur aus Preisgründen (8, 10).
Von den 18 neuen Wirkstoffen des Jahres 2000, die im Jahre 2001 mehr als 20000 mal verordnet wurden, sind – wie die genannten Beispiele – elf in die Bewertungs-Gruppe C eingestuft worden, d.h. umsatzorientierte Neuerungen, kein therapeutischer Fortschritt. Würde hier kritischer verordnet, ergäbe sich nach den Berechnungen des Arzneiverordnungs-Reports ein Einsparpotential von 1,48 Milliarden EUR!
Demgegenüber gibt es dreimal eine klare A-Beurteilung (neuartiges Wirkprinzip mit therapeutischer Relevanz), nämlich für Etanercept (Enbrel), Levetiracetam (Keppra) und Trastuzumab (Herceptin). Etanercept ist ein Antagonist des Tumornekrosefaktors, der wie Infliximab in der Rheumatherapie eingesetzt werden kann. Levetiracetam ist ein Antiepileptikum mit neuem Wirkprinzip und Trastuzumab ein monoklonaler Antikörper zur Immuntherapie des metastasierten Mammakarzinoms. Es gibt also auch bemerkenswerten Fortschritt auf dem Arzneimittelmarkt, der sich durchsetzt. Aber die dafür geforderten Preise sind fast unerschwinglich. Sehr strenge Indikationsstellungen sind erforderlich und harte Diskussionen über die Preisgestaltung (14).
Auch der „Arzneimittelskandal“ um Cerivastatin (Lipobay/Zenas) schlägt sich im Report nieder. Cerivastatin war erst 1997 zugelassen worden. Myopathien und Rhabdomyolysen waren als Risiko der Therapie mit Statinen wohl bekannt. Cerivastatin schien sich von den Mitbewerbern aber durch günstige pharmakokinetische Daten auszuzeichnen. 2001 gab es bis zum August 107 Millionen verordnete Tagesdosen in Deutschland mit einem Umsatz von etwa 110 Millionen EUR. Dann wurde es wegen erhöhter Inzidenz von Myopathien in den USA weltweit vom Hersteller vom Markt genommen (11). Die Nachanalyse ergab ein erhöhtes Risiko bei hoher Dosierung (0,8 mg) und auch in Kombination mit Gemfibrozil sowie Clopidogrel. Der ”Skandal“ ist die logische Folge unseres Zulassungs-Systems, das Arzneimittel zu rasch auf den Markt läßt. Andererseits aber ist er ein ”Erfolg” des Spontanerfassungssystems von UAW, das zwar unzuverlässig ist, aber eine zentrale und – wie man sieht – wirksame Rolle spielen kann.
Bupropion (Zyban) ist im Jahr 2000 zur Raucherentwöhnung eingeführt worden und hat sich nicht durchgesetzt. Hier hatte es nicht nur Warnungen von Fachleuten gegeben (z.B. 12, 13), sondern auch eine laute Kampagne in den Medien mit Hinweisen auf die bedrohlichen UAW im Vergleich zur Nikotinersatz-Therapie. Mit wohlgesonnenen starken Partnern kann also Kritik auch etwas bewirken.
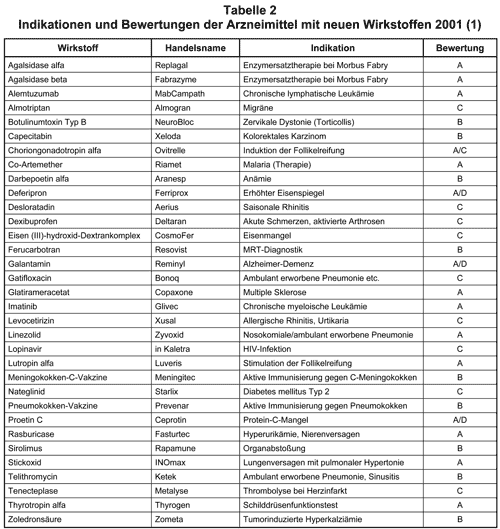
Im Jahre 2001 sind 33 Arzneistoffe in Deutschland neu in die Therapie eingeführt worden (s. Tab. 2). Fünfzehnmal wurde die Bewertung „A“ vergeben, nur neunmal die Bewertung „C“. Im Vergleich zum Vorjahr ist dieses Votum positiver. Wir werden sehen, ob dies auch zu rationaler und wirtschaftlicher Verordnung führt oder ob wieder die „Me-too“-Präparate, die Nachahmer-Päparate, einen hohen Anteil der Arzneimittel-Kosten verschlingen. Erste Anzeichen sprechen dafür. Von den sechs am häufigsten verordneten Arzneimitteln, die im Jahre 2001 zugelassen worden sind, hatten vier die Bewertung „C“.
Wie kommt es, daß die Mehrzahl der Ärzte und Apotheker offenbar evidenzbasierte Richtlinien und therapeutischen Fortschritt nicht zur Grundlage ihrer Entscheidungen macht? Weil sie dazu verführt werden, Neuerung für Fortschritt zu halten. So jedenfalls argumentiert die ISDB in ihrer „Deklaration zu Fortschritten in der medikamentösen Therapie“. Der Arzneiverordnungs-Report läßt erkennen, daß es viele Möglichkeiten zu einer effektiveren Therapie gibt.
Bei der Konzeption der Zulassungsstudien – meist von den Herstellern bezahlt – werden häufig die CONSORT-Qualitäts-Kriterien (15) nicht beachtet und dadurch Wirksamkeit und Bedeutung eines neuen Arzneimittels überzeichnet. So sind z.B. Art und Zahl der Test-Personen oft unzureichend; darüber hinaus wird häufig gegen Plazebo oder auf Äquipotenz und nicht auf Überlegenheit gegenüber einem bereits erprobten Therapieprinzip getestet; nicht selten werden im Sinne gewünschter Ergebnisse „geeignete“ Vergleichs-Dosierungen und Endpunkte gewählt u.s.w. Nicht alle Studienergebnisse werden veröffentlicht, sondern überwiegend die positiven.
Die europäische Arzneimittelbehörde (EMEA) ist nicht der Generaldirektion Gesundheit und Verbraucherschutz zugeordnet, sondern der Generaldirektion Wirtschaft. Das läßt erkennen, woher dort der Wind bläst. Das Profil der UAW von Arzneimitteln kann nach der immer kürzeren Erprobungsphase vor der Zulassung schlichtweg nicht bekannt sein. Es gibt auch keine Verpflichtung, neue Medikamente als solche zu kennzeichnen, damit auch die Patienten Bescheid wissen und sich an der Meldung von Nebenwirkungen beteiligen können. Ebenso gibt es für Behörden und Industrie keine Auflagen, nach der Zulassung die Häufigkeit von UAW systematisch zu erfassen und zu veröffentlichen. So wird es immer wieder zu überraschenden Rücknahmen der Zulassung kommen müssen.
Die Marketingstrategen der pharmazeutischen Industrie lassen keine Methode aus, die ihnen geeignet scheint, Ärzte und Patienten zu höheren Umsätzen ihrer Arzneimittel zu veranlassen. Die Organisatoren von Zulassungsstudien, oft Leiter universitärer Einrichtungen, werden – im kommerziellen Sinne erfolgreich – als Meinungsbildner eingesetzt. Hochglanzbroschüren werden unaufgefordert verteilt und verordnenden Ärzten Vorteile vermittelt. Auch die Medien sehen ihre Vorteile bei diesen Vorgängen, und im Bemühen, ihre Einnahmen durch Werbeanzeigen der Pharmaindustrie zu mehren, bleibt oft nicht ohne Einfluß auf die Meinung in den Redaktionen.
DER ARZNEIMITTELBRIEF will als unabhängiges Informationsblatt seine Leser auch im Neuen Jahr dabei unterstützen, effektive und dem echten therapeutischen Fortschritt verpflichtete Pharmakotherapie zu betreiben, indem er
· kritisch über neue Entwicklungen informiert,
· die Methoden aufzeigt, mit denen bewußt die Grenzen zwischen Information und Werbung verwischt werden,
· gegen die Verführungskünste der Umsatzstrategen immunisiert,
· die Aufmerksamkeit schärft, UAW alter und neuer Arzneimittel zu erkennen und zu melden,
· die Motivation stärkt, in der Gesundheitspolitik die Interessen des Kommerz in Grenzen zu halten.
Literatur
- Schwabe, U., und Paffrath, D.: Arzneiverordnungs-Report 2002. Springer, Berlin, Heidelberg, New York.
- www.isdbweb.org/
- AMB 2001, 35, 39b.
- Gottlieb, S.: Brit. Med. J. 2001, 323, 301; s.a. AMB 2002, 36, 41.
- AMB 2001, 35, 38a.
- Prescrire International 2001, 10, 83.
- AMB 2002, 36, 9.
- AMB 2002, 36, 17.
- Arzneimittelkommission der deutschen Ärzteschaft: Dtsch. Ärztebl. 2002, 99, C680.
- AMB 2002, 36, 73.
- AMB 2001, 35, 70.
- AMB 2000, 34, 25.
- AMB 2001, 35, 43.
- AMB 2002, 36, 33 und 65.
- AMB 2001, 35, 46.