Edoxaban ist ein weiterer direkter Faktor-Xa-Antagonist, der auf den lukrativen Gerinnungshemmer-Markt drängt und die Vitamin-K-Antagonisten (VKA) ablösen soll. Edoxaban muss wie Rivaroxaban nur einmal täglich eingenommen werden. Der Wirkstoff wird von Daiichi Sankyo hergestellt und ist seit 2011 in Japan unter dem Handelsnamen Lixiana® für die Thromboseprophylaxe bei orthopädischen Eingriffen zugelassen. Der Zulassungsantrag bei der EMA und FDA wird für das erste Quartal 2014 erwartet. Dies wird nun in einer Publikationsoffensive im N. Engl. J. Med. vorbereitet.
In der Hokusai-VTE Studie (1) wurde Edoxaban in der Sekundärprophylaxe bei über 8000 Patienten nach venöser Thromboembolie mit/ohne Lungenembolie und vorausgegangener Therapie mit Heparin getestet. Es ergab sich, dass 60 mg/d Edoxaban symptomatische Rezidivereignisse ebenso effektiv verhindert wie Warfarin (3,2% vs. 3,5%), aber signifikant weniger Blutungen verursacht (8,5% vs. 10,3%; Hazard Ratio = HR: 0,81; 95%-Konfidenzintervall = CI: 0,71-0,94; p = 0,004 für Überlegenheit).
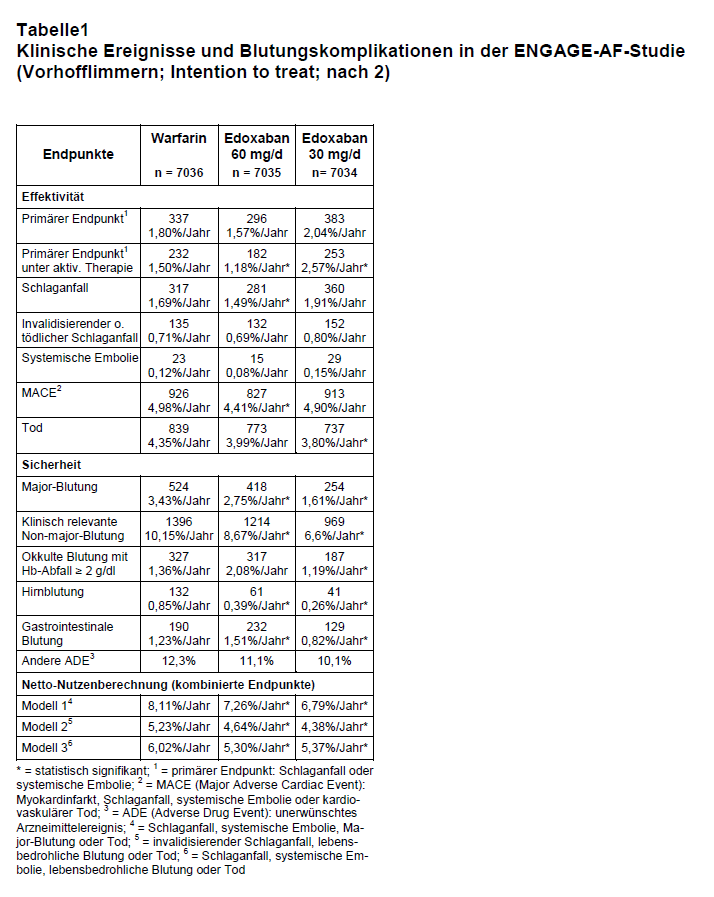
Ob dieser Vorteil in der Sicherheit gegenüber einem VKA auch bei der Indikation Vorhofflimmern besteht, sollte in der ENGAGE-AF-TIMI-48-Studie nachgewiesen werden (2). Sie ist die bislang größte Studie zu einem neuen oralen Antikoagulans (NOAK). Zwischen 2008 und 2010 wurden weltweit an 1393 Zentren über 21.000 Patienten mit Vorhofflimmern eingeschlossen. Der CHADS2-Score sollte ≥ 2 sein (vgl. 3). Ausgeschlossen waren u.a. Patienten mit stark eingeschränkter Nierenfunktion (Kreatinin-Clearance < 30 ml/min), einem "erhöhten Blutungsrisiko" oder einer Indikation zur dualen Plättchenhemmung. Das mediane Alter der Patienten betrug 72 Jahre, 40% waren ≥ 75 Jahre, 38% Frauen; der mittlere CHADS2-Score betrug 2,8. Die Patienten erhielten in drei Behandlungsarmen Edoxaban (30 mg/d oder 60 mg/d) oder Warfarin (Ziel-INR: 2-3). Bei einer Kreatininclearance von 30-50 ml/min, einem Körpergewicht unter 60 kg oder bei einer Komedikation mit einem Arzneimittel, das mit Glykoprotein P interagiert (Verapamil, Chinidin, Dronedaron), wurde die Edoxaban-Dosis halbiert (von 60 mg/d auf 30 mg/d bzw. von 30 mg/d auf 15 mg/d). Die Patienten erhielten die Studienmedikation doppeltblind mit Doppel-dummy und allen wurden INR-Werte mitgeteilt, also auch denen, die Edoxaban einnahmen (Schein-INR).
Primärer Effektivitätsendpunkt war der Zeitpunkt bis zum ersten Schlaganfall oder bis zur ersten systemischen Thromboembolie. Primärer Sicherheitsendpunkt waren Major-Blutungen nach der TIMI-Klassifikation. Die mediane Beobachtungszeit betrug 2,8 Jahre.
Ergebnisse: Nur etwa ein Drittel der Patienten nahm die Antikoagulanzien während der gesamten Studiendauer ein: 34,5% in der Warfarin-, 37,4% in der Hochdosis- und 38,2% in der Niedrigdosis-Edoxaban-Gruppe. Ein Drittel unterbrach die Medikation mindestens einmal im Studienverlauf, und 34,5% bzw. 34,4% bzw. 33,0% setzten die Studienmedikation ganz ab. Die Gründe hierfür waren ein unerwünschtes Ereignis, das Erreichen eines Studienendpunkts (16,7% bzw. 17,2% bzw. 15,6%) oder der Wunsch des Patienten bzw. des behandelnden Arztes (12,4% bzw. 11,9% und 12,7%). Bei 25,3% wurde Edoxaban von Beginn an in halber Dosis zugeteilt, bei weiteren 7,1% wurde dies im Laufe der Studie erforderlich. Diese Zahlen zeigen, dass auch die Therapie mit Edoxaban häufig unterbrochen und die Dosierung angepasst werden muss. Im Warfarin-Arm befanden sich 68,4% der Patienten während der Einnahmezeit im INR-Zielbereich, und bei 83,1% der Messungen lag die INR zwischen 1,8 und 3,2. Dies ist die beste Einstellung in allen großen NOAK-Studien.
Den primären Effektivitätsendpunkt (Schlaganfall, systemische Embolie) erreichten über den gesamten Studienzeitraum 232 Patienten mit VKA (dies entspricht einer Rate von 1,5%/Jahr), 182 Patienten mit 60 mg/d Edoxaban (1,18%/Jahr) und 253 Patienten mit 30 mg/d Edoxaban (1,61%/Jahr). Diese Unterschiede waren nicht signifikant (s. Tab. 1). Die berechnete Hazard-Ratio (HR) gegenüber Warfarin betrug für die hohe Edoxaban-Dosis 0,87 (97,5%-CI: 0,73-1,04; p = 0,08) und 1,13 für die niedrige Edoxaban-Dosis (97,5%-CI: 0,96-1,34; p = 0,1). Beide Edoxaban-Dosierungen sind Warfarin in der Effektivität also nicht unterlegen. In einer zweiten Berechnung des primären Endpunkts nur für die Zeit, in der die Patienten auch tatsächlich antikoaguliert waren, ergab sich für den primären Endpunkt ein signifikanter Vorteil für die hohe Dosis Edoxaban (HR: 0,79; CI: 0,63-0,99; p < 0,001) und ein Nachteil für die niedrige Edoxaban-Dosierung (HR: 1,07; CI: 0,87-1,31; p = 0,005).
Hinsichtlich Blutungskomplikationen schnitt Edoxaban günstiger ab als Warfarin. Die jährliche Rate an Major-Blutungen betrug 3,43% mit Warfarin, 2,75% mit 60 mg/d Edoxaban und 1,61% mit 30 mg/d Edoxaban (HR gegenüber Warfarin: 0,8; CI: 0,71-0,91 bzw. HR: 0,47; CI: 0,41-0,55). Weitere Ereignisse sind in Tab. 1 wiedergegeben. Bemerkenswert sind vermehrte gastrointestinale Blutungen unter Edoxaban-Hochdosis und eine geringere Letalität unter der Niedrigdosis. Letzteres wird sicherlich bei einer späteren Vermarktung des Arzneimittels eine große Rolle spielen.
Entsprechend wurden nun Berechnungen des Netto-Nutzens auf Basis der Ereignisse während der aktiven Behandlungszeit angestellt. Diese Rechenmodelle waren aber offensichtlich vorher nicht definiert (3). Demnach ergibt sich bei einem zusammengesetzten Endpunkt aus Tod, Schlaganfall, systemischer Embolie oder Major Blutung (Modell 1 in Tab. 1) ein Vorteil von 0,85 Prozentpunkten/Behandlungsjahr für 60 mg/d Edoxaban (NNT: 117) und von 1,32 Prozentpunkten/Behandlungsjahr für 30 mg/d Edoxaban (NNT: 76) gegenüber Warfarin.
Vier der 21 Autoren sind Mitarbeiter der Herstellerfirma, alle übrigen unterhalten umfangreiche Beziehungen zur Industrie (Beratertätigkeit, Vorträge, Forschungsstipendien). Bemerkenswert ist auch, dass sie versichern, alle Analysen selbst vorgenommen und den Text der Publikation selbst verfasst zu haben und dass es kein vertragliches Recht für Daiichi Sankyo gab, die Datenanalyse zu beeinflussen bzw. die Publikation zu verhindern.
Fazit: Edoxaban ist ein Faktor-Xa-Antagonist aus Japan, der bei Patienten mit Beinvenenthrombosen, pulmonalen Embolien und Vorhofflimmern ein günstigeres Nutzen/Risiko-Profil zu haben scheint als Warfarin. Es fällt auf, dass die Hersteller mit der vorgeschlagenen Dosis vorsichtiger werden. Der sekundäre Endpunkt in der ENGAGE-AF-Studie, „Net clinical benefit“, wird im Wesentlichen durch die Wahl einer niedrigen Dosis günstig beeinflusst. Wie auch bei den drei anderen bereits zugelassenen NOAK, kann die antikoagulatorische Wirkung von Edoxaban nicht exakt gemessen werden, und es gibt ebenfalls kein Antidot.
Literatur
- TheHokusai-VTE Investigators: N. Engl. J. Med. 2013, 369, 1406. Link zur Quelle
- Giuliagno,R., et al. (ENGAGE AF-TIMI 48 = Effective anticoagulation with Factor Xa – Next Generation in Atrial Fibrillation- Thrombolysis In Myocardial Infarction 48): N.Engl. J. Med. 2013, 369, 2093. Link zur Quelle
- AMB2012, 46, 17 Link zur Quelle und AMB 2011, 45, 73. Link zur Quelle
- Ruff, T.R., etal. (ENGAGEAF-TIMI 48 = Effective anticoagulation with Factor Xa – Next Generation in Atrial Fibrillation- Thrombolysis In Myocardial Infarction 48): Am.Heart J. 2010, 160, 635. Link zur Quelle