Wir haben 2014 und 2017 ausführlich über Technik, Indikation sowie Erfolgs- und Komplikationsraten der Ablation bei Vorhofflimmern (VHF) berichtet. Bislang sahen wir in der komplikationsträchtigen (> 7%) und teuren Methode in erster Linie eine Therapieoption bei symptomatischen Patienten in frühen Krankheitsstadien ohne bedeutsame strukturelle Herzkrankheit (1).
Nun gibt es aktuelle Daten, die möglicherweise eine Neubewertung der Ablation bei Vorhofflimmern erforderlich machen. Die CASTLE-AF-Studie (2) testete die Auswirkungen der Ablation bei Patienten mit VHF und Herzinsuffizienz, also bei Patienten mit einer häufig gemeinsam bestehenden strukturellen Herzerkrankung. CASTLE-AF war eine offene, multizentrische, randomisierte, kontrollierte klinische Studie. Die Rekrutierung der Patienten erfolgte zwischen 2008 und 2016 an 33 Zentren in Europa, Australien und den USA. Sie wurde von der Firma Biotronik (Hersteller von Schrittmachersystemen und Ablationszubehör) gesponsert und kürzlich im N. Engl. J. Med. publiziert (2). Fast alle Autoren haben multiple Interessenkonflikte mit der Industrie, darunter auch mit dem Sponsor der Studie.
Eingeschlossen wurden Patienten mit symptomatischem VHF und Herzinsuffizienz sehr unterschiedlichen Schweregrads (NYHA-Klasse I : 11%; Klasse II: 58%; Klasse III: 29%; Klasse IV: 2%; jeweils nach medikamentöser Optimierung in einer 5-wöchigen Run-In Phase). Die linksventrikuläre Ejektionsfraktion (LVEF) betrug im Median 32,5%; interquartiler Bereich 25,0-38,0%). Alle Patienten mussten Träger eines Biotronik-Defibrillators sein, entweder eines Cardioverter-Defibrillators (ICD) zur Primärprophylaxe eines Plötzlichen Herztods (Klasse-1-Indikation bei LVEF ≤ 35% trotz optimaler medikamentöser Therapie) oder eines Zwei-Kammer-Schrittmachers zur kardialen Resynchronisationstherapie mit Defibrillatorfunktion (CRT-D). Der Grund für dieses sehr selektive Einschlusskriterium war, dass über diese Geräte eine telemetrische Überwachung des Rhythmus erfolgen sollte.
Das VHF konnte paroxysmal (mindestens zwei Episoden > 30 Sek. Dauer in drei Monaten) oder persistierend sein (≥ eine Episode in drei Monaten, Dauer > 7 Tage oder kürzer bei Kardioversion). Die Patienten mussten mit den üblichen Antiarrhythmika (v.a. Betablocker, Digitalis, Amiodaron, Sotalol) unzureichend behandelbar sein, diese nicht vertragen oder deren Einnahme abgelehnt haben. Von der Studienteilnahme ausgeschlossen waren u.a. auch Patienten mit sehr großem linken Vorhof (> 6 cm), mit vorausgegangener Vorhofablation, mit kürzlich vorausgegangener oder geplanter Koronarrevaskularisation, unbehandelter Schilddrüsenfunktionsstörung, unkontrolliertem Hypertonus oder dialysepflichtiger Niereninsuffizienz. Durch die vielen Ein- und Ausschlusskriterien kamen von 3.013 gescreenten Patienten nur 398 für die Studie in Frage (13,2%; im Mittel nur 12 pro Zentrum über acht Jahre). Wesentliche Gründe für die hohe Zahl an Ausschlüssen waren Schrittmachersysteme von anderen Herstellern, asymptomatisches VHF, geplante Revaskularisationen oder Herztransplantation.
Nach der Randomisierung wurden 35 Patienten vor der ersten Untersuchung während einer fünfwöchigen Run-in-Phase, in der die Herzinsuffizienz-Medikation optimiert werden sollte, noch ausgeschlossen (Gründe: 18 zogen ihre Einwilligung zurück, 9 „in Übereinstimmung mit dem Protokoll“, 6 konnten nicht nachbeobachtet werden und 2 starben).
Die Intention-to-treat (ITT)-Analyse erfolgte dann mit (nur) 363 verbliebenen Patient(inn)en. Deren medianes Alter betrug 64 Jahre; sie waren also relativ jung. Die Mehrzahl (85%) waren Männer und 32% hatten paroxysmales VHF. Einen ICD trugen 72% und 27% ein CRT-D-System. Zugelost wurden 179 Patienten der Ablationsgruppe und 184 der medikamentösen Gruppe (Kontrollen). Patienten in der Kontrollgruppe hatten signifikant häufiger eine ischämische Genese ihrer Herzinsuffizienz (52% vs. 40%), häufiger einen Herzinfarkt (36% vs. 28%) oder einen Diabetes mellitus (37% vs. 28%) und nahmen zum Zeitpunkt der Randomisierung deutlich häufiger Diuretika ein (91% vs. 55%). Viele dieser Unterschiede in den bei den Studienteilnehmern vorhandenen Risiken finden sich etwas versteckt im Supplement der Publikation (Tab. S2) und werden von den Autoren nicht weiter erklärt. Diese Unterschiede könnten sich zuungunsten der Kontrollgruppe ausgewirkt haben.
Ziel der Ablation war die Isolation aller Pulmonalvenen und die Wiederherstellung des Sinusrhythmus. Die Techniken und Materialien waren den Zentren überlassen. Von 179 randomisierten Patienten erhielten 151 (84,4%) eine Ablation und 28 (15,6%) wurden – abweichend vom Protokoll – doch nur medikamentös behandelt (cross over). Die Isolierung der Pulmonalvenen war bei nahezu allen Patienten erfolgreich (98,7%); bei 51,7% wurde der Eingriff durch zusätzliches Setzen von Vorhofläsionen erweitert. Bei 37 Patienten (24,5%) erfolgte in der Nachbeobachtungsphase ein Zweiteingriff wegen Rezidiven von VHF. Bei 7,8% trat in Folge der Ablation eine Komplikation auf, die in 3,7% als schwerwiegend klassifiziert wurde (Perikarderguss, transfusionsbedürftige Blutung, Lungenvenenstenose).
Die Behandlungsstrategie in der Kontrollgruppe war freigestellt, sie sollte sich an den gültigen Leitlinien orientieren. Bei 70% wählten die behandelnden Ärzte eine Frequenzkontrolle und bei 30% eine Rhythmuskontrolle des VHF. Bei der letzten Visite erhielten 91% einen Betablocker, 34% Digitalis und 35% ein Klasse-III- oder Klasse-I-Antiarrhythmikum, meist Amiodaron. Die korrespondierenden Raten in der Ablationsgruppe waren 90%, 14% und 27%. Eine Ablation fand bei 18 Patienten der Kontrollgruppe statt (cross over 9,8%).
Die Nachbeobachtung der Patienten erfolgte telemetrisch über die Schrittmacheraggregate, die jede Episode von VHF aufzeichneten sowie durch klinische Visiten nach 3, 6, 12, 24, 36, 48, und 60 Monaten. Während der mittleren Nachbeobachtungszeit von drei Jahren konnten in der Ablationsgruppe 23 Patienten (12,8%) nicht weiter verfolgt werden und in der Kontrollgruppe 10 (5,4%). Dieser Unterschied bleibt auch unerklärt und ist ein weiteres bedeutsames Risiko für eine Verzerrung der Ergebnisse.
Der primäre Studienendpunkt war zusammengesetzt aus Tod (alle Ursachen) bzw. ungeplanter Krankenhausbehandlung wegen Herzinsuffizienz. Ereignisse, die in der 12-wöchigen sog. “blanking period” nach der Ablation auftraten, wurden, bis auf Todesfälle, nicht in die „intention-to-treat“ (ITT)-Analyse einbezogen und werden in der Publikation auch nicht erwähnt.
Ergebnisse: Die mittlere Nachbeobachtungszeit betrug in beiden Gruppen rund 37 Monate. Bei der ersten geplanten Interimsanalyse zeigte sich, dass sowohl die Rekrutierungsrate als auch die Ereignisrate geringer war als erwartet und dass das angepeilte Ziel von 195 primären Endpunkten in der geplanten Zeit nicht erreichbar war. Daher entfiel die vorgesehene zweite Interimsanalyse, und die Studie wurde vorzeitig beendet, nachdem 133 primäre Endpunkte eingetreten waren.
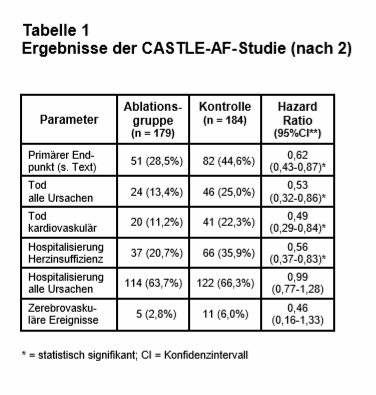
Nach 60 Monaten befanden sich 63% der Patienten in der Ablationsgruppe im Sinusrhythmus und 22% in der Kontrollgruppe. Der primäre Endpunkt trat deutlich und signifikant seltener in der Ablationsgruppe auf (28,5% vs. 44,6%; p = 0,006). Die Number needed to treat (NNT) beträgt 8,3. Der Nutzen ergibt sich sowohl durch das Überleben als auch durch weniger Krankenhausaufnahmen wegen Herzinsuffizienz (s. Tab. 1). Ob und wie oft die Schrittmachersysteme, die überwiegend zur Primärprophylaxe des Plötzlichen Herztods bereits implantiert waren, in beiden Gruppen aktiv geworden sind, wird nicht mitgeteilt. Bei den Subgruppenanalysen ergaben sich Hinweise darauf, dass Patienten > 65 Jahre, in höheren NYHA-Stadien und mit einer sehr stark reduzierten LVEF (< 25%) möglicherweise keinen oder nur einen geringen Nutzen von der Ablation haben.
In dem begleitenden Editorial wird bereits von einem Paradigmenwechsel gesprochen, zugleich aber auch vor einer zu raschen und unkritischen Anwendung der Ablationsbehandlung bei der o.g. Patientengruppe gewarnt (3). Einerseits, weil die untersuchte Patientenzahl klein und die Patientenauswahl sehr selektiv war und andererseits, weil bei der Randomisierung und Gruppenzuteilung keine adäquate Verblindung bestand. Aus unserer Sicht sollte auch nochmals darauf hingewiesen werden, dass mehrere Risiken für bedeutsame Ergebnisverzerrungen vorliegen (u.a. Allocation und Attritionsbias; vgl. 4). Daher sollten vor einer generellen Änderung der Strategie zur Ablation bei VHF die Ergebnisse weiterer Studien abgewartet werden (z.B. CABANA, EAST; 5, 6).
Fazit: Aus der randomisierten, kontrollierten CASTLE-AF-Studie gibt es Hinweise, dass die Vorhofablation bei symptomatischem, paroxysmalem oder persistierendem Vorhofflimmern bei einer kleinen Subgruppe von Patienten mit symptomatischer Herzinsuffizienz und unzureichender Behandelbarkeit mit Antiarrhythmika die Prognose verbessern kann. Während einer dreijährigen Nachbeobachtung mussten diese Patienten (die weiterhin medikamentös weiterbehandelt wurden) im Vergleich zu den ausschließlich medikamentös weiterbehandelten Kontrollpatienten signifikant seltener wegen Herzinsuffizienz stationär behandelt werden; auch Todesfälle waren seltener. Allerdings birgt die Studie mehrere Risiken für eine bedeutsame Verzerrung der Ergebnisse zugunsten der Ablationsbehandlung. Bevor also von einem „Paradigmenwechsel“ gesprochen werden kann, müssen die Ergebnisse durch weitere und größere Studien bestätigt werden, denn durch Design und Ablauf sind die Aussagen dieser Studie zu stark eingeschränkt.
Literatur
- AMB 2014, 48, 81 Link zur Quelle . AMB 2017, 51, 14. Link zur Quelle
- Marrouche, N.F., et al. (CASTLE-AF = Catheter Ablation vs. Standard conventional Treatment in patients with LV dysfunction and Atrial Fibrillation): N. Engl. J. Med. 2018, 378, 417. Link zur Quelle
- Link, M.S.: Engl. J. Med. 2018, 378, 468. Link zur Quelle
- AMB 2017, 51, 64DB01. Link zur Quelle
- CABANA = Catheter ABlation vs ANti-arrhythmic drug therapy for Atrial fibrillation trial: Link zur Quelle
- EAST = Early treatment of Atrial fibrillation for Stroke prevention Trial: Link zur Quelle