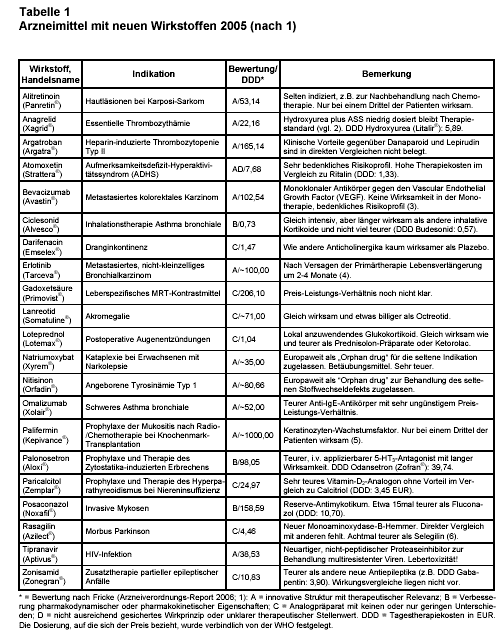
Im Arzneiverordnungs-Report 2006 (1) sind 21 Arzneimittel mit neuen Wirkstoffen aufgeführt (Tab. 1), von denen allerdings nur 11 wirklich innovativ sind, d.h. ein neuartiges Wirkprinzip mit klinischer Relevanz haben (Bewertung A nach Fricke). Wenn man diejenigen Arzneimittel noch hinzuzählt, die zwar nicht innovativ, aber verbessert sind bezüglich Pharmakodynamik und/oder Pharmakokinetik (Bewertung B nach Fricke), so sind 14 (67%) der neuen Arzneimittel „fortschrittlich”. Im Vorjahr waren es nur 55%. Aber ist der so definierte Fortschritt wirklich ein Fortschritt der Pharmakotherapie, der sich auch praktisch auswirkt? Ist die hier gewählte Definition von Fortschritt nicht zu theoretisch-pharmakologisch? Muss ein als „fortschrittlich” bezeichnetes Medikament nicht verglichen worden sein mit den Medikamenten, die schon im Handel sind und zwar nach Wirkung, unerwünschten Arzneimittelwirkungen (UAW) und Tagestherapiekosten? Wenn man sich daraufhin die Arzneimittel der Bewertungsgruppen A und B ansieht, ist bei vielen kein für die Praxis bedeutsamer Fortschritt zu erkennen, obwohl es sich um „innovative Strukturen” handelt. Die neuen Substanzen sind bezüglich ihrer Wirkung und UAW fast nie mit schon vorhandenen Medikamenten direkt verglichen worden. Bei indirektem Vergleich sind aber gleich wirksame Dosierungen der neuen Präparate meist viel teurer als die älteren Vergleichspräparate (z.B. Anagrelid, Palonosetron; s. Tab. 1). Das ist kein Fortschritt.
In einigen Fällen ist zusätzlich das UAW-Profil der innovativen Substanzen bedenklich oder nicht ausreichend untersucht. So haben wir uns mehrfach sehr zurückhaltend zur Pharmakotherapie des Aufmerksamkeitsdefizit-Hyperaktivitätssyndroms mit Ritalin geäußert (7). Nun ist zusätzlich für die selbe Indikation Atomoxetin (Strattera®) zugelassen worden, das zwar ein geringeres Missbrauchspotenzial haben soll, aber zu bedrohlichen Suizidideen führen kann. Zudem wird es in Abhängigkeit von der CYP2D6-Aktivität von einigen Patienten deutlich verlangsamt abgebaut. Dadurch können gefährlich hohe Plasmaspiegel resultieren. Obwohl es also bezüglich der UAW unübersichtlicher und auch noch teurer ist (s. Tab. 1) als das umstrittene Ritalin, ist Atomoxetin die „innovative Struktur”, die am häufigsten von allen neuen Medikamenten (131900 Rezepte) und mit dem höchsten Umsatz (11,9 Mio. EUR) verordnet worden ist.
Ebenso verwundert die Verordnungshäufigkeit von Anagrelid (Xagrid®; 2) zur Behandlung der essentiellen Thrombozythämie. Trotz des fehlenden Zusatznutzens im Vergleich zu Hydroxyurea (Litalir®) plus ASS und des vergleichsweise hohen Preises (DDD: 22,16 EUR; DDD Litalir®: 5,89 EUR, s. Tab. 1), hat auch Anagrelid einen erstaunlich guten Start gehabt: Es wurde bereits im Jahr der Zulassung 18800 mal verordnet mit einem Umsatz von 10,4 Mio. EUR (Litalir® 65000 Verordnungen, 9,9 Mio. EUR Umsatz). Auf dem Pharmamarkt wirken sich also hohe Preise nicht immer ungünstig auf den Umsatz aus. Die Methoden der Werbung sind offenbar wirksamer als die rationale Analyse des Preis-Leistungs-Verhältnisses. Erwarten die Firmen von hohen Preisen einer Substanz sogar einen Werbeeffekt (vgl. 10)?
Ausnahmen bestätigen die Regel. Nicht immer werden neue Medikamente mit verbesserten Eigenschaften teurer verkauft. Ciclesonid (Alvesco®) ist ein neues inhalatives Glukokortikoid mit längerer Halbwertszeit. Es gehört also wegen günstigerer Pharmakokinetik in die Gruppe B und kostet nicht mehr (DDD: 0,62 EUR) als die vergleichbaren Glukokortikoide Beclometason (DDD: 0,73 EUR) oder Fluticason (DDD: 1,46 EUR). Etwas billiger ist nur Budesonid (DDD: 0,57 EUR). Auch Ciclesonid hatte mit 110000 Verordnungen und einem Umsatz von 6,0 Mio. EUR im Jahr der Einführung einen guten Start.
Innovative Strukturen sind auch Bevacizumab und Omalizumab. Bevacizumab ist ein rekombinanter, humanisierter Antikörper gegen den Vascular Endothelial Growth Factor und damit ein interessantes neues Prinzip der Krebstherapie, das auch zur Behandlung der feuchten Makuladegeneration eingesetzt werden kann (8). Die Ergebnisse in der Praxis sind allerdings noch nicht überzeugend. Wir haben uns bei der Einführung zurückhaltend und kritisch zum Stellenwert in der Onkologie geäußert (3). Auch Omalizumab ist ein monoklonaler humanisierter Antikörper. Er ist gegen IgE gerichtet, das in der Pathogenese des allergischen Asthma bronchiale eine zentrale Rolle spielt. Es wäre eine sehr zielgenaue Therapie, wenn es gelänge, IgE zu inaktivieren und so den Krankheitsprozess des allergischen Asthmas zu unterbrechen. Leider sind auch hier die Ergebnisse noch nicht überzeugend. Darüber hinaus ist Omalizumab für die breite Anwendung viel zu teuer.
Für seltene Indikationen (Nitisinon gegen angeborene Tyrosinämie bzw. Natriumoxybat gegen Kataplexie bei Narkolepsie), gibt es spezielle Innovationen, die nicht oft gebraucht und keinen großen Umsatz machen werden. Aber für die Betroffenen sind diese Stoffe eine existentielle und innovative Hilfe. Sie wurden von der EMEA als Orphan Drugs (Waisenkinder-Medikamente, für die sich keiner interessiert) für alle Mitgliedsländer zentral zugelassen.
Sieben Wirkstoffe wurden in die Gruppe C eingegliedert (keine oder nur geringe Unterschiede im Vergleich zu bereits eingeführten Präparaten). Ein Beispiel ist Darifenacin, ein Anticholinergikum zur Behandlung der Dranginkontinenz ohne erkennbaren zusätzlichen Nutzen. Anders als die meisten Analoga ist es allerdings nicht teurer als viele Vergleichspräparate (DDD: 1,58 EUR). Auch Darifenacin hatte mit 65100 Verordnungen und einem Umsatz von 7,2 Mio. EUR im Jahr der Zulassung eine gute Resonanz. In Tab. 1 finden sich aber drei Beispiele für Analogpräparate, die deutlich teurer sind als die Vergleichssubstanzen, ohne dass sie einen zusätzlichen Nutzen erkennen lassen: Paricalcitrol, Palonosetron und Rasagilin.
Die unbegründet häufige Verordnung teurer Analogpräparate haben wir bereits im Dezember 2006 dargestellt an Hand der Verordnungszahlen zu Lasten der Barmer Ersatzkasse in Berlin und der Zahlen des Arzneiverordnungs-Reports 2006 (9). Wenn teure Analogpräparate bei der Verordnung vermieden würden, könnten 1,6 Milliarden EUR/Jahr gespart werden. Die Industrie verdient gut an den Analogpräparaten und nutzt ihren Einfluss auf allen Ebenen. Der Arzneiverordnungs-Report nennt eine ganze Reihe von Möglichkeiten, den Einfluss der Industrie zu minimieren: z.B.:
· Unabhängige Information ohne Werbung
· Verbot von Umsatzbeteiligungen für Ärzte
· Keine Ärztemuster
· Positivliste
· Einheitliche Preisgestaltung für Apotheken in Krankenhaus und Ambulanz
· Einführung einer prozentualen Zuzahlung für Patienten mit Obergrenze, aber ohne Mindestbetrag
· Informationen der Verbraucher über Arzneimittelleistungen und -preise.
Fazit: 14 neue Arzneimittel des Jahres 2005 haben entweder eine innovative Struktur mit klinischer Relevanz oder sind verbessert bezüglich Pharmakokinetik oder -dynamik. Sieben neue Medikamente sind Analogpräparate. Bei allen drei Gruppen sind die Preissteigerungen gegenüber Vergleichspräparaten erheblich, ohne dass in der Regel ein klinisch bedeutsamer Zusatznutzen der Innovationen erwartet werden kann. Medizinischer Fortschritt ist nur in einigen Fällen zu erkennen. Die Ausgaben für Arzneimittel dürften also nicht steigen.
Literatur
- Schwabe, U., und Paffrath, D.: Arzneiverordnungs-Report 2006. Springer, Berlin, Heidelberg, New York.
- AMB 2005, 39, 68. Link zur Quelle
- AMB 2005, 39, 1. Link zur Quelle
- AMB 2005, 39, 61. Link zur Quelle
- AMB 2005, 39, 12. Link zur Quelle
- AMB 2005, 39, 62a. Link zur Quelle
- AMB 2001, 35, 12 Link zur Quelle und 88. Link zur Quelle
- AMB 2006, 40, 91. Link zur Quelle
- AMB 2006, 40, 90. Link zur Quelle
- Busch, W.: 1884, Maler Klecksel. Erstes Kapitel: Mit scharfem Blick, nach Kennerweise, seh’ ich zunächst mal nach dem Preise. Und bei genauerer Betrachtung, steigt mit dem Preise auch die Achtung.